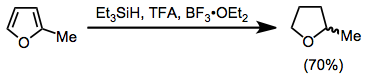Reducciones con hidrosilanos
Las reducciones con hidrosilanos son métodos utilizados para hidrogenaciones e hidrogenólisis de compuestos orgánicos. El enfoque es un subconjunto de hidrogenaciones iónicas. En este método particular, el sustrato se trata con un reactivo de hidrosilano y un auxiliar, a menudo un ácido fuerte, lo que resulta en una transferencia formal de hidruro de silicio a carbono..[1] Este estilo de reducción con hidrosilanos disfruta de aplicaciones diversas especializadas.
Alcance[editar]
Desoxigenación de alcoholes y haluros[editar]
Algunos alcoholes se reducen a alcanos cuando se tratan con hidrosilanos en presencia de un fuerte ácido de Lewis. Los ácidos Brønsted también se pueden usar. Los alcoholes terciarios sufren una reducción fácil utilizando el eterato de trifluoruro de boro como el ácido de Lewis.[2] Los alcoholes primarios requieren un exceso de silano, un ácido de Lewis más fuerte y largos tiempos de reacción.[3]
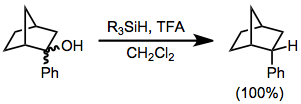
Los reordenamientos esqueléticos a veces se inducen.[4] Otra reacción lateral es el ataque nucleofílico de la base conjugada en el carbocatión intermedio.[5] En las reducciones de organosilano de sustratos que llevan grupos prostereogénicos, la diastereoselectividad a menudo es alta. La reducción del diastereómero de 2-fenil-2-norbornanol conduce exclusivamente al diastereómero endo de 2-fenilnorbornano.[6] Ninguno de los exo diastereómero se observó.
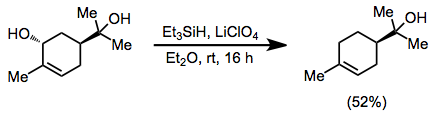
Los alcoholes alílicos pueden desoxigenarse en presencia de alcoholes terciarios cuando el perclorato de litio etéreo se emplea como fuente de Li+.[7]
Las reducciones de haluros y triflatos de alquilo dan rendimientos más pobres en general que las reducciones de los alcoholes. Se requiere un ácido de Lewis o uno de Brønsted.[8]
Reducción de carbonilos[editar]
- Aldehídos y cetonas
Se pueden emplear hidrosilanos poliméricos, como el polimetilhidrosiloxano (PHMS) para facilitar la separación de los productos reducidos de los subproductos que contienen silicio.[9][10]
Las reducciones enantioselectivas de las cetonas se pueden lograr mediante el uso de cantidades catalíticas de complejos de metales de transición quiral.[11] En algunos casos, el metal de transición simplemente sirve como un ácido de Lewis que coordina con el oxígeno de cetona; Sin embargo, algunos metales (más notablemente de cobre) reaccionan con los hidrosilanos para proporcionar intermedios de hidruro metálico, que actúan como el agente reductor activo.[12]
En presencia de catalizador de rodio 1 y tricloruro de rodio, la 2-fenilciclohexanona se reduce sin diastereoselectividad sino enantioselectividad alta.[13]
- Ésteres
Los ésteres pueden reducirse a alcoholes en condiciones de activación nucleofílica con cesio o fluoruro de potasio.[14]
Los aldehídos sufren hidrosililación en presencia de hidrosilanos y fluoruro. Los éteres de sililo resultantes pueden hidrolizarse con ácido clorhídrico 1 M. Los rendimientos óptimos de la hidrosililación se obtienen cuando la reacción se lleva a cabo en solventes muy polares.[10]
|
|
(13) |
Reducción de los enlaces C=C[editar]
Los hidrosilanos pueden reducir los dobles enlaces 1,1 disustituidos que forman carbocataciones terciarias estables tras la protonación. Los enlaces dobles trisUnsubstituidos pueden reducirse selectivamente en presencia de alquenos 1,2-disustituidos o monosubstituidos.[15]
Los compuestos aromáticos pueden reducirse con TFA y trietilsilano. Los furanos sustituidos se reducen a derivados de tetrahidrofurano con alto rendimiento.[16]
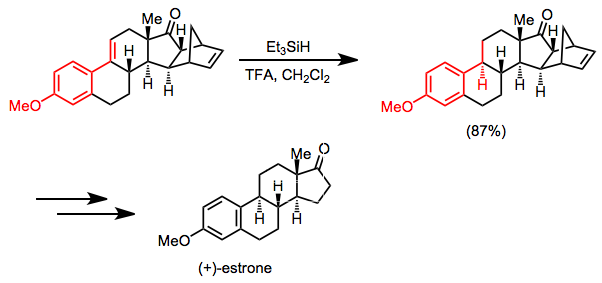
Una síntesis de (+)-Estrona se basa en la reducción selectiva de hidrosilano de un alqueno conjugado como un paso clave. El carbonilo de cetona y el doble enlace aislado no se ven afectados por las condiciones que se muestran.[17]
Escisión de éter[editar]
Los acetales, cetales y aminales se reducen en presencia de hidrosilanos y ácido. La reducción selectiva del sitio de acetales y cetales cuyos oxígenos son inequivalentes; el ejemplo a continuación se usa en una síntesis de tamiflu.[18]
Otros grupos funcionales que se han reducido con hidrosilanos incluyen amidas,[19] ésteres α,β insaturados[20] enaminas,[21] iminas,[22] y azidas.[23]
Referencias[editar]
- ↑ Larson, Gerald L.; Fry, James L. (2008). «Ionic and Organometallic-Catalyzed Organosilane Reductions». Organic Reactions: 1-737. ISBN 978-0471264187. doi:10.1002/0471264180.or071.01.
- ↑ Kraus, George A.; Molina, Maria Teresa; Walling, John A. (1986). «Reduction of cyclic hemiacetals. The synthesis of demethoxyeleutherin and nanaomycin A». Journal of the Chemical Society, Chemical Communications (21): 1568. doi:10.1039/C39860001568.
- ↑ Gevorgyan, Vladimir; Rubin, Michael; Benson, Sharonda; Liu, Jian-Xiu; Yamamoto, Yoshinori (September 2000). «A Novel B(C6F5)3-Catalyzed Reduction of Alcohols and Cleavage of Aryl and Alkyl Ethers with Hydrosilanes †». The Journal of Organic Chemistry 65 (19): 6179-6186. PMID 10987957. doi:10.1021/jo000726d.
- ↑ Adlington, Merwyn G.; Orfanopoulos, Michael; Fry, James L. (August 1976). «A convenient one-step synthesis of hydrocarbons from alcohols through use of the organosilane-boron trifluoride reducing system». Tetrahedron Letters 17 (34): 2955-2958. doi:10.1016/S0040-4039(01)85498-8.
- ↑ Doyle, Michael P.; McOsker, Charles C. (February 1978). «Silane reductions in acidic media. 10. Ionic hydrogenation of cycloalkenes. Stereoselectivity and mechanism». The Journal of Organic Chemistry 43 (4): 693-696. doi:10.1021/jo00398a039.
- ↑ Carey, Francis A.; Tremper, Henry S. (January 1969). «Carbonium ion-silane hydride transfer reactions. II. 2-Phenyl-2-norbornyl cation». The Journal of Organic Chemistry 34 (1): 4-6. doi:10.1021/jo00838a002.
- ↑ Wustrow, David J.; Smith, William J.; Wise, Lawrence D. (January 1994). «Selective deoxygenation of allylic alcohols and acetates by lithium perchlorate promoted triethylsilane reduction». Tetrahedron Letters 35 (1): 61-64. doi:10.1016/0040-4039(94)88162-6.
- ↑ Barclay, L. R. C.; Sonawane, H. R.; MacDonald, M. C. (15 de enero de 1972). «Sterically Hindered Aromatic Compounds. III. Acid-catalyzed Reactions of 2,4,6-Tri- t -butyl- and 2-Methyl-4,6-di-t-butylbenzyl Alcohols and Chlorides». Canadian Journal of Chemistry 50 (2): 281-290. doi:10.1139/v72-041.
- ↑ Pri-Bar, Ilan; Buchman, Ouri (March 1986). «Homogeneous, palladium-catalyzed, selective hydrogenolysis of organohalides». The Journal of Organic Chemistry 51 (5): 734-736. doi:10.1021/jo00355a029.
- ↑ a b Fujita, Makoto; Hiyama, Tamejiro (November 1988). «Fluoride ion-catalyzed reduction of aldehydes and ketones with hydrosilanes. Synthetic and mechanistic aspects and an application to the threo-directed reduction of .alpha.-substituted alkanones». The Journal of Organic Chemistry 53 (23): 5405-5415. doi:10.1021/jo00258a003.
- ↑ Larson, Gerald L.; Liberatore, Richard J. (26 de julio de 2021). «Organosilanes in Metal-Catalyzed, Enantioselective Reductions». Organic Process Research & Development: acs.oprd.1c00073. doi:10.1021/acs.oprd.1c00073.
- ↑ Lipshutz, Bruce H.; Noson, Kevin; Chrisman, Will; Lower, Asher (July 2003). «Asymmetric Hydrosilylation of Aryl Ketones Catalyzed by Copper Hydride Complexed by Nonracemic Biphenyl Bis - phosphine Ligands». Journal of the American Chemical Society 125 (29): 8779-8789. PMID 12862472. doi:10.1021/ja021391f.
- ↑ Nishiyama, Hisao; Park, Soon-Bong; Itoh, Kenji (August 1992). «Stereoselectivity in hydrosilylative reduction of substituted cyclohexanone derivatives with chiral rhodium-bis(oxazolinyl)pyridine catalyst». Tetrahedron: Asymmetry 3 (8): 1029-1034. doi:10.1016/S0957-4166(00)86036-X.
- ↑ Corriu, R.J.P.; Perz, R.; Reye, C. (January 1983). «Activation of silicon-hydrogen, silicon-oxygen, silicon-nitrogen bonds in heterogeneous phase». Tetrahedron 39 (6): 999-1009. doi:10.1016/S0040-4020(01)88599-9.
- ↑ Kursanov, D. N.; Parnes, Z. N.; Bolestova, G. I. (May 1968). «Ionic hydrogenation of anthracene and dihydroanthragene with a hydride ion donor». Bulletin of the Academy of Sciences of the USSR Division of Chemical Science 17 (5): 1107. doi:10.1007/BF00910867.
- ↑ Bolestova, G. I.; Parnes, Z. N.; Kursanov, D. N. J. Org. Chem. USSR (Engl. Transl.) 1979, 15, 1129.
- ↑ Takano, Seiichi; Moriya, Minoru; Ogasawara, Kunio (March 1992). «A concise stereocontrolled total synthesis of (+)-estrone». Tetrahedron Letters 33 (14): 1909-1910. doi:10.1016/S0040-4039(00)74175-X.
- ↑ Federspiel, Muriel; Fischer, Rolf; Hennig, Michael; Mair, Hans-Jürgen; Oberhauser, Thomas; Rimmler, Gösta; Albiez, Thomas; Bruhin, Jürg; Estermann, Heinrich; Gandert, Carsten; Göckel, Volker; Götzö, Stephan; Hoffmann, Ursula; Huber, Gabriel; Janatsch, Günter; Lauper, Stephan; Röckel-Stäbler, Odette; Trussardi, Rene; Zwahlen, Andreas G. (July 1999). «Industrial Synthesis of the Key Precursor in the Synthesis of the Anti-Influenza Drug Oseltamivir Phosphate (Ro 64-0796/002, GS-4104-02): Ethyl (3 R ,4 S ,5 S )-4,5-epoxy-3-(1-ethyl-propoxy)-cyclohex-1-ene-1-carboxylate». Organic Process Research & Development 3 (4): 266-274. doi:10.1021/op9900176.
- ↑ Selvakumar, Kumaravel; Harrod, John F. (2001). «Titanocene-Catalyzed Coupling of Amides in the Presence of Organosilanes To Form Vicinal Diamines». Angewandte Chemie International Edition 40 (11): 2129-2131. doi:10.1002/1521-3773(20010601)40:11<2129::AID-ANIE2129>3.0.CO;2-2.
- ↑ Ojima, Iwao; Kumagai, Miyoko; Nagai, Yoichiro (May 1976). «Hydrosilylation of α,β-unsaturated nitriles and esters catalyzed by tris (triphenylphosphine)chlororhodium». Journal of Organometallic Chemistry 111 (1): 43-60. doi:10.1016/S0022-328X(00)87057-6.
- ↑ Rosentreter, U. (1985). «Stereoselective Synthesis of all- trans -Isomers of 1,2,3,4-Tetrahydropyridines and Piperidines from Hantzsch-Type 1,4-Dihydropyridines». Synthesis 1985 (2): 210-212. doi:10.1055/s-1985-31160.
- ↑ Loim, N. M. (June 1968). «Ionic hydrogenation of the C=N linkage in azomethynes». Bulletin of the Academy of Sciences of the USSR Division of Chemical Science 17 (6): 1345. doi:10.1007/BF01106312.
- ↑ Chandrasekhar, S.; Chandraiah, L.; Reddy, Ch. Raji; Reddy, M. Venkat (July 2000). «Direct Conversion of Azides and Benzyl Carbamates to t- Butyl Carbamates Using Polymethylhydrosiloxane and Pd-C». Chemistry Letters 29 (7): 780-781. doi:10.1246/cl.2000.780.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Reductions with hydrosilanes» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.



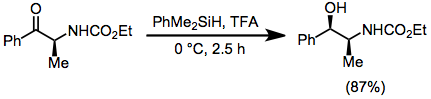



![{\displaystyle {\ce {{\mathit {n}}-C10H21CHO}}+{\color {Blue}{\ce {PhMe2Si}}}{\ce {H->[{\ce {TBAF}}][{\ce {rt}}]{\mathit {n}}-C10H21CH2O}}{\color {Blue}{\ce {SiMe2Ph}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9215e2c1a06a3a1733ad5394e9b472acfb6daa54)