Tropinona
| Tropinona | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 8-Metil-8-azabiciclo[3.2.1]octan-3-ona | ||
| General | ||
| Otros nombres | 3-Tropinona | |
| Fórmula estructural |
 | |
| Fórmula molecular | C8H13NO | |
| Identificadores | ||
| Número CAS | 532-24-1[1] | |
| ChEBI | 16656 | |
| ChemSpider | 393722 | |
| DrugBank | DB01874 | |
| PubChem | 446337 | |
| UNII | 2A8CC8KA5F | |
|
CN1[C@@H]2CC[C@H]1CC(=O)C2
| ||
| Propiedades físicas | ||
| Apariencia | Sólido marrón | |
| Masa molar | 139 195 g/mol | |
| Punto de fusión | 42,5 °C (316 K) | |
| Punto de ebullición | (descompone) | |
| Peligrosidad | ||
| NFPA 704 |
1
2
0
| |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La tropinona es un alcaloide, sintetizado en 1917 por Robert Robinson como precursor sintético de la atropina, un bien escaso durante la Primera Guerra Mundial.[2][3] La tropinona y los alcaloides cocaína y atropina comparten la misma estructura central de tropano. Su ácido conjugado correspondiente a pH 7,3, la especie principal, se conoce como tropiniumona.[4]
Síntesis[editar]
La primera síntesis de tropinona fue realizada por Richard Willstätter en 1901. Comenzó a partir de la cicloheptanona aparentemente relacionada, pero requirió muchos pasos para introducir el puente de nitrógeno; el rendimiento general de la ruta de síntesis es solo del 0,75 %.[5] Willstätter había sintetizado previamente cocaína a partir de tropinona, en lo que fue la primera síntesis y aclaración de la estructura de la cocaína.[6]

La reacción del 'doble Mannich' de Robinson[editar]
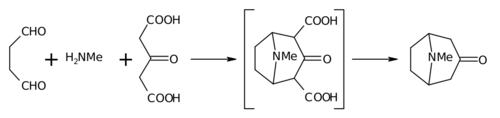
La síntesis de 1917 de Robinson se considera un clásico en la síntesis total[8] debido a su simplicidad y enfoque biomimético. La tropinona es una molécula bicíclica, pero los reactivos utilizados en su preparación son bastante simples: succinaldehído, metilamina y ácido acetonadicarboxílico (o incluso acetona). La síntesis es un buen ejemplo de reacción biomimética o síntesis de tipo biogenético porque la biosíntesis utiliza los mismos componentes básicos. También demuestra una reacción en tándem en una síntesis de un solo recipiente. Además, el rendimiento de la síntesis fue del 17 % y con las mejoras posteriores superó el 90 %.[5]
Esta reacción se describe como una 'reacción de Mannich doble' intramolecular por razones obvias. No es único en este sentido, ya que otros también lo han intentado en la síntesis de piperidina.[9][10]
En lugar de acetona, el ácido acetonadicarboxílico se conoce como el 'equivalente sintético'. Los grupos de ácido 1,3-dicarboxílico se denominan 'grupos activadores' para facilitar las reacciones de formación de anillos. La sal de calcio está allí como un 'tampón', ya que se afirma que son posibles rendimientos más altos si la reacción se lleva a cabo a un 'pH fisiológico'.
Mecanismo de reacción[editar]
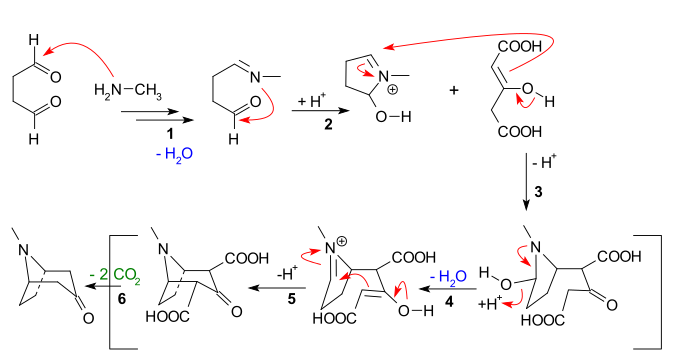
Las principales características evidentes de la siguiente secuencia de reacción son:
- Adición nucleófila de metilamina a succinaldehído, seguida de pérdida de agua para crear una imina
- Adición intramolecular de la imina a la segunda unidad de aldehído y cierre del primer anillo
- Reacción de Mannich intermolecular del enolato de dicarboxilato de acetona
- Nueva formación de enolato y nueva formación de imina con pérdida de agua para
- Segunda reacción intramolecular de Mannich y segundo cierre de anillo
- Pérdida de 2 grupos carboxílicos a tropinona
De hecho, algunos autores han intentado retener uno de los grupos CO2H.[11] La CO2R-tropinona tiene 4 estereoisómeros, aunque el éster alquílico de ecgonidina correspondiente tiene solo un par de enantiómeros.
De cicloheptanona[editar]
La deshidrogenación (oxidación) IBX de cicloheptanona (suberona) a 2,6-cicloheptadienona [1192-93-4] seguida de reacción con una amina es una forma versátil de formar tropinonas.[12][13] El mecanismo evocado está claramente delineado como una doble reacción de Michael (es decir, adición conjugada).
Método bioquímico[editar]
[14]
Reducción de tropinona[editar]
La reducción de tropinona está mediada por enzimas reductasas dependientes de NADPH, que se han caracterizado en múltiples especies de plantas.[15] Todas estas especies de plantas contienen dos tipos de enzimas reductasas, tropinona reductasa I y tropinona reductasa II. TRI produce tropina y TRII produce pseudotropina. Debido a las diferentes características cinéticas y de pH/actividad de las enzimas y por la actividad 25 veces mayor de TRI sobre TRII, la mayor parte de la reducción de tropinona es de TRI para formar tropina.[16]

Referencias[editar]
- ↑ Número CAS
- ↑ Robinson, R. (1917). «LXIII. A Synthesis of Tropinone». Journal of the Chemical Society, Transactions 111: 762-768. doi:10.1039/CT9171100762.
- ↑ Nicolaou, K. C.; Vourloumis, D.; Winssinger, N.; Baran, P. S. (2000). «The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century». Angewandte Chemie International Edition 39 (1): 44-122. PMID 10649349. doi:10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L.
- ↑ Chemical Entities of Biological Interest Identification code: ChEBI:57851 "tropiniumone"
- ↑ a b Smit, Wim A.; Smit, William A.; Bochkov, Alekseĭ Feodosʹevich; Caple, Ron (1998). Organic Synthesis. ISBN 978-0-85404-544-0. doi:10.1039/9781847551573.
- ↑ Humphrey, A. J.; O'Hagan, D. (2001). «Tropane alkaloid biosynthesis. A century old problem unresolved». Natural Product Reports (Royal Society of Chemistry) 18 (5): 494-502. PMID 11699882. doi:10.1039/b001713m.
- ↑ Doble, Mukesh; Kruthiventi, Anil Kumar (2007). Green Chemistry and Engineering. Oxford: Elsevier. p. 34. ISBN 978-0-12-372532-5.
- ↑ Birch, A. J. (1993). «Investigating a Scientific Legend: The Tropinone Synthesis of Sir Robert Robinson, F.R.S». Notes and Records of the Royal Society of London 47 (2): 277-296. JSTOR 531792. S2CID 143267467. doi:10.1098/rsnr.1993.0034.
- ↑ Wang, S.; Sakamuri, S.; Enyedy, I. J.; Kozikowski, A. P.; Deschaux, O.; Bandyopadhyay, B. C.; Tella, S. R.; Zaman, W. A. et al. (2000). «Discovery of a novel dopamine transporter inhibitor, 4-hydroxy-1-methyl-4-(4-methylphenyl)-3-piperidyl 4-methylphenyl ketone, as a potential cocaine antagonist through 3D-database pharmacophore searching. Molecular modeling, structure-activity relationships, and behavioral pharmacological studies». Journal of Medicinal Chemistry 43 (3): 351-360. PMID 10669562. doi:10.1021/jm990516x.
- ↑ Wang, S.; Sakamuri; Enyedy; Kozikowski; Zaman; Johnson (2001). «Molecular modeling, structure--activity relationships and functional antagonism studies of 4-hydroxy-1-methyl-4-(4-methylphenyl)-3-piperidyl 4-methylphenyl ketones as a novel class of dopamine transporter inhibitors». Bioorganic & Medicinal Chemistry 9 (7): 1753-1764. PMID 11425577. doi:10.1016/S0968-0896(01)00090-6.
- ↑ Findlay, S. P. (1957). «Concerning 2-Carbomethoxytropinone». Journal of Organic Chemistry 22 (11): 1385-1394. doi:10.1021/jo01362a022.
- ↑ Patente USPTO n.º 8609690
- ↑ Nicolaou, K. C.; Montagnon, T.; Baran, P. S.; Zhong, Y. L. (2002). «Iodine(V) reagents in organic synthesis. Part 4. O-Iodoxybenzoic acid as a chemospecific tool for single electron transfer-based oxidation processes». Journal of the American Chemical Society 124 (10): 2245-58. PMID 11878978. doi:10.1021/ja012127+.
- ↑ Bedewitz, Matthew A.; Jones, A. Daniel; D’Auria, John C.; Barry, Cornelius S. (2018). «Tropinone synthesis via an atypical polyketide synthase and P450-mediated cyclization». Nature communications 9 (1): 5281. Bibcode:2018NatCo...9.5281B. ISSN 2041-1723. PMC 6290073. PMID 30538251. doi:10.1038/s41467-018-07671-3.
- ↑ A. Portsteffen; B. Draeger; A. Nahrstedt (1992). «Two tropinone reducing enzymes from Datura stramonium transformed root cultures». Phytochemistry 31 (4): 1135. doi:10.1016/0031-9422(92)80247-C.
- ↑ Boswell HD, Dräger B, McLauchlan WR (November 1999). «Specificities of the enzymes of N-alkyltropane biosynthesis in Brugmansia and Datura». Phytochemistry 52 (5): 871-8. PMID 10626376. doi:10.1016/S0031-9422(99)00293-9.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Tropinone» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.