Tubo polar


El tubo polar o filamento polar es un orgánulo especializado de invasión celular, único y característico de las esporas de los parásitos intracelulares denominados Microsporidios.[1][2]
El filamento polar es hueco y está preparado para ser el conducto para inocular el material infeccioso.
El tubo sumamente enrollado dentro de la espora, en condiciones adecuadas del medio del huésped, se desenrolla hacia el exterior (extrusión) para permitir la consiguiente inoculación en una célula sana, proceso que se denomina 'germinación de espora'.
El tubo es la causa de la infección de las células de un organismo, denominada Microsporidiosis.
Características[editar]
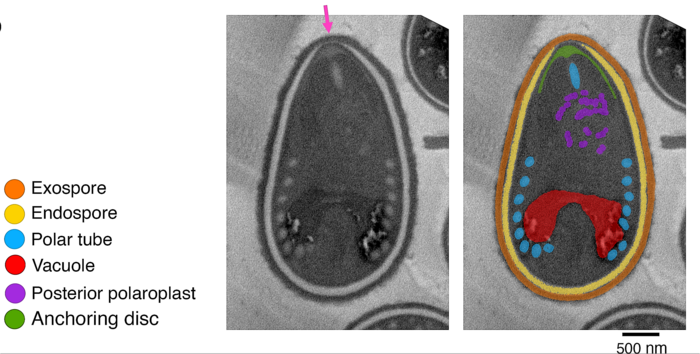
El tubo polar (TP) es un orgánulo especializado único en su tipo. Es una estructura macromolecular larga, delgada y hueca, con forma de arpón, que es utilizada para invadir a una célula huésped.
En su fase infectiva el TP se desenrrolla de forma explosiva, fuera de la espora que lo contiene, hasta 20-35 veces la longitud de la espora. Se han registrado longitudes de TP entre 50-300 micrómetros (μm).[3]
El TP como estructura hueca es el conducto que permite inocular el contenido de la espora (esporoplasma) que incluye el genoma del microsporidio.
Estructura[editar]
El tubo polar (TP) es una estructura supra-macromolecular delgada y hueca. Dentro de la espora, este orgánulo tubular adopta una disposición enrollada similar a un resorte y se conoce como filamento polar.
arriba centro: el segmento lineal,
abajo lateral: espiral. Corte longitudinal de la espora. Microscopía electrónica.

El enrollamiento del filamento polar puede variar desde 4 a 30 vueltas/espiras,[4][5] dependiendo del microsporidio. En Anncaliia algerae/Brachiola algerae/Nosema algerae se pudieron contar entre 7 y 12 espiras.[3] En Vairomorpha necatrix el filamento polar mostró hasta 12-13 vueltas (coils en inglés).[6]
El diámetro del tubo polar desenrollado es de aproximadamente 0,1 a 0,2 µm (100-200 nanómetros (nm)) y puede ampliarse hasta 600 nm para facilitar el pasaje de las cargas intracelulares voluminosas.[7]
En V. necatrix el diámetro de los tubos polares (TP) varía desde 60 nm hasta 190 nm dependiendo de su contenido interno.[8]
El filamento polar estudiado en sección transversal con microscopía electrónica,
está compuesto de capas concéntricas de diferentes densidades y espesores, que incluyen básicamente: el área densa externa, el área transparente media y el área densa interna.[7]
El filamento muestra de 3 a 20 capas concéntricas, electro-lucidas y electro-densas, con un núcleo interno de material particulado denso a los electrones.[5] En V. necatrix se han encontrado hasta 6 capas.[6]
El espesor de las capas varía a lo largo del filamento, mientras que el número de capas varía con la madurez de las esporas. Se ha observado un patrón diferente de capas antes, durante y después de la extrusión.[5]
El tubo polar está compuesto por proteínas, y se han informado varias proteínas del tubo polar (PTP) diferentes en los microsporidios.[7]
En 2022 se habían identificado seis tipos de PTP (proteína 1 del tubo polar PTP1, PTP2, PTP3, PTP4, PTP5, PTP6, PTP7).[9][10]
Las propiedades mecánicas de los componentes del TP permiten la transición explosiva desde el estado compacto al extendido además de la rápida translocación de carga en 1 o 2 segundos.[8]
Aparato polar de invasión[editar]
Para invadir la célula huésped, los microsporidios utilizan orgánulos específicos y especializados que son: el filamento polar, el disco de anclaje y el polaroplasto.[11][5][8]

Filamento polar[editar]
El filamento polar se divide para su estudio en dos sectores:
- el segmento lineal del filamento que emana de la punta anterior de la espora y se extiende hacia el extremo posterior, rodeado por el polaroplasto,
- la espiral del filamento, ubicado en la parte media y posterior de la espora, que rodea el núcleo y los orgánulos citoplasmáticos asociados.[6]
El enrollamiento del filamento polar puede variar desde 4 a 30 vueltas/espiras.
En A. algerae el segmento enrollado del filamento consta de 7-12 vueltas en promedio.[3]
El filamento enrollado tiene unos 70 nanómetros (nm) de diámetro.
El filamento polar extruído (evertido), se denomina tubo polar (TP) y puede penetrar la membrana de la célula objetivo, para anclar la espora en esa célula e invadirla.
Disco de anclaje[editar]
El disco de anclaje (DA) forma una estructura en forma de paraguas en la punta anterior de la espora, debajo de la región más delgada de la endospora. El DA es el sitio de germinación de las esporas y, por lo tanto, es necesaria una reorganización o interrupción de este para permitir la salida del tubo TP.
Polaroplasto[editar]
El polaroplasto (PPL) es un orgánulo membranoso de múltiples capas. Normalmente, el PPL consta de dos sectores con diferentes morfologías, el polaroplasto anterior y el polaroplasto posterior.
El polaroplasto anterior es el más cercano al extremo anterior de la espora, donde protruye el tubo TP.
El polaroplasto posterior rodea la parte lineal del tubo TP, estabiliza esta zona y contribuye con la membrana al tubo.
Se cree que el PPL es importante durante el proceso de 'germinación', proporcionando la membrana necesaria para mantener el aumento de la superficie durante el transporte a través del tubo TP.[3]
Función[editar]
La función del tubo polar (TP) es servir como conducto hueco, para que el material infeccioso (esporoplasma) ingrese a la célula huésped y establezca un nicho de replicación.
Todo el proceso, desde el inicio de la extrusión del tubo TP hasta la finalización del transporte de la carga a través del tubo, se denomina 'germinación de espora'.
El evento de 'germinación' necesita una serie de eventos que incluyen cambios en el ambiente del huésped, y que son necesarios para activar la espora.[12]

Cuando las esporas 'germinan' se produce un disparo explosivo en el polo apical, que transforma el filamento polar en un estado extendido en forma de tubo, conocido como tubo polar (TP).
La activación del filamento polar para transformarse en tubo polar (TP) tiene inicio en la zona apical de la capa interna de la pared de la espora (endospora).
El cambio inicial es un abultamiento del extremo apical de la espora, acompañado de un estrechamiento de la cubierta de la envoltura interna en esa zona.
El “complejo de unión apical” del filamento, sus membranas asociadas y el filamento inactivo, se reorientan tras la activación de la espora.
El complejo apical se everte, formando una estructura similar a un collarín a medida que el filamento, ahora denominado tubo polar (TP), sale fuera de la espora.[12]
Los tubos en extensión fuera de la espora pueden alcanzar una velocidad máxima media de 281 micrómetros/segundo (μm/s). V. necatrix evierte su tubo polar a la longitud máxima en menos de 1 segundo y expulsa el esporoplasma de la punta del tubo.[8][3]
Varias especies de Encephalitozoon tardan menos de 500 milisegundos (ms) en disparar y pasar la carga infecciosa a través del tubo polar. En A. algerae la velocidad con la que extruye el tubo polar es de hasta 300 micrómetros/segundo (μm/s), y necesita 1,6 s para todo el proceso.[7]
Vairomorpha necatrix evierte su tubo polar (TP) a la longitud máxima en menos de 1 segundo y expulsa el esporoplasma de la punta del tubo.[8]
Véase también[editar]
Referencias[editar]
- ↑ «Un estudio revela que los microsporidios son hongos y que podrían tener reproducción sexual». Agencia Sinc. 4 de febrero de 2009.
- ↑ Cruz Choappa R. (2018). «El phylum Microsporidia». Rev. chil. infectol. (Santiago, Chile: SciELO) 35 (1). doi:10.4067/s0716-10182018000100073. Consultado el 3 de abril de 2024.
- ↑ a b c d e Jaroenlak P.; Cammer M.; Davydov A.; Sall J.; Usmani M.; Liang F-X.; Ekiert D.C.; Bhabha G. (2020). «3-Dimensional organization and dynamics of the microsporidian polar tube invasion machinery.». PLOS Pathogens (Public Library of Science) 16 (9): e1008738. doi:10.1371/journal.ppat.1008738. Consultado el 27 de marzo de 2024.
- ↑ «Espira». DRAE.
- ↑ a b c d Xu Y.; Weiss L.M. (2005). «The microsporidian polar tube: A highly specialised invasion organelle». Int J Parasitol. 35 (9): 941-953. PMC 3109658. doi:10.1016/j.ijpara.2005.04.003. Consultado el 30 de marzo de 2024.
- ↑ a b c Moore C.B.; Brooks W.M. (1992). «An Ultrastructural Study of Vairimorpha necatrix (Microspora, Microsporida) with Particular Reference to Episporontal Inclusions During Octosporogony» (PDF). Journal of Eukaryotic Microbiology (ResearchGate) 39 (3): 392-398. doi:10.1111/j.1550-7408.1992.tb01469.x. Consultado el 28 de marzo de 2024.
- ↑ a b c d Chen Y.; Lv Q.; Liao H.; Xie Z.; Hong L.; Qi L.; Pan G.; Long M.; Zhou Z. (2023). «The microsporidian polar tube: origin, structure, composition, function, and application». Parasites & Vectors (REVISIÓN) 16 (305). PMC 10468886. Consultado el 31 de marzo de 2024.
- ↑ a b c d e Sharma H.; Jespersen N.; Ehrenbolger K.; Carlson LA.; Barandun J. (2024). «Ultrastructural insights into the microsporidian infection apparatus reveal the kinetics and morphological transitions of polar tube and cargo during host cell invasion.». PLoS Biology (Public Library of Science) 22 (2): e3002533. doi:10.1371/journal.pbio.3002533. Consultado el 26 de marzo de 2024.
- ↑ Lv Q.; Zhou B.; Liao H.; He X.; Chen Y.; Pan G.; Long M.; Zhou Z. (2022). «Proteomic profile of polar filament and polar tube from fungal pathogen microsporidium Nosema bombycis provides new insights into its unique invasion organelle». J Proteomics 263: 104617. PMID 35595055. doi:10.1016/j.jprot.2022.104617. Consultado el 1 de abril de 2024.
- ↑ Fayet M.; Prybylski N.; Collin M-L; Peyretaillade E.; Wawrzyniak I.; Belkorchia A.; Reginald Florian Akossi; Diogon M.; El Alaoui H.; Polonais V.; Delbac F. (2023). «Identification and localization of polar tube proteins in the extruded polar tube of the microsporidian Anncaliia algerae». Scientific Reports 13: 8773. PMC 10229552. PMID 37253964. doi:10.1038/s41598-023-35511-y. Consultado el 5 de abril de 2024.
- ↑ Delbac F.; Peuvel I.; Metenier G.; Eric Peyretaillade; Vivares C.P. (2001). «Microsporidian Invasion Apparatus: Identification of a Novel Polar Tube Protein and Evidence for Clustering of ptp1 and ptp2 Genes in Three Encephalitozoon Species». Infectology Immunology (Infect Immun.) 69 (2): 1016-1024. PMC 97982. PMID 11159998. doi:10.1128/IAI.69.2.1016-1024.2001. Consultado el 30 de marzo de 2024.
- ↑ a b Han B.; Takvorian P.M.; Weiss L.M. (2020). «Invasion of Host Cells by Microsporidia». Frontiers in Microbiology (REVISIÓN) 11: 172. PMC 7040029. PMID 3213298. doi:10.3389/fmicb.2020.00172. Consultado el 30 de marzo de 2024.
Enlaces externos[editar]
- Página de Microbewiki
- Página del CDC Centro de Control de Enfermedades.