Usuario:3treinta/Eritropoyesis
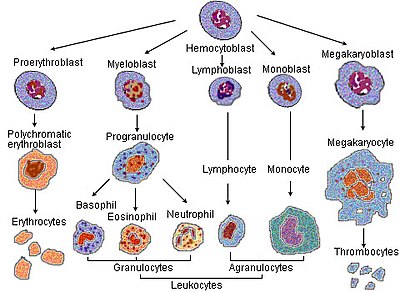
La eritropoyesis (del griego 'eritro', que significa "rojo", y "poiesis", que significa "hacer") es el proceso de producción de glóbulos rojos (eritrocitos). Se estimula mediante la disminución de O2 en la circulación, detectada por los riñones, que entonces secretan la hormona eritropoyetina.[2] Esta hormona estimula la proliferación y diferenciación de los precursores de los glóbulos rojos, lo que activa el aumento de la eritropoyesis en los tejidos hematopoyéticos y, en última instancia, en la producción de glóbulos rojos. Por lo general, en las aves y los mamíferos (seres humanos incluidos) recién nacidos, esto se produce dentro de la médula ósea roja. En los fetos en desarrollo inicial, la eritropoyesis tiene lugar en las células mesodermales del saco vitelino. Al tercer o cuatro mes, la eritropoyesis se traslada al hígado.[3] Transcurridos siete meses, la eritropoyesis tiene lugar en la médula ósea. El aumento de la actividad física puede producir un aumento de la eritropoyesis.[4] Sin embargo, en humanos con ciertas enfermedades y en algunos animales, la eritropoyesis también puede tener lugar fuera de la médula ósea, en el bazo o en el hígado. Esta recibe el nombre de eritropoyesis extramedular.
La médula ósea de prácticamente todos los huesos produce glóbulos rojos hasta que una persona alcanza aproximadamente los cinco años de edad. La tibia y el fémur dejan de ser centros de hematopoyesis alrededor de los 25 años de edad; las vértebras, el esternón, la pelvis, las costillas y los huesos del cráneo siguen produciendo glóbulos rojos durante el resto de la vida.
Diferenciación de eritrocitos[editar]
En el proceso de maduración del corpúsculo rojo, una célula sufre una serie de diferenciaciones. Las siguientes etapas de desarrollo se producen dentro de la médula ósea:
- un hemocitoblasto, una célula madre hematopoyética multipotente, se convierte en
- un progenitor mieloide común o una célula madre multipotente, y luego
- en una célula madre unipotente, después
- en un pronormoblasto, también comúnmente llamado proeritroblasto o rubriblasto. vp cc
- este se convierte en un normoblasmo basófilo o temprano, también comúnmente llamado eritroblasto, después
- en un normoblasto policromófilo o intermedio, luego
- en un normoblasto ortocromático o tardío. En esta etapa el núcleo es expulsado antes de que la célula se convierta en
- un reticulocito.
La célula se libera de la médula ósea después de la 7.ª etapa y, por lo tanto, en los glóbulos rojos de reciente circulación hay aproximadamente un 1 % de reticulocitos.--- Después de uno o dos días, estos últimos se convierten en "eritrocitos" o glóbulos rojos maduros.
Estas etapas se corresponden con aspectos específicos de la célula cuando se tiñen con la tinción de Wright y se examinan mediante microscopía óptica, y se corresponden con otros cambios bioquímicos.
En el proceso de maduración, un pronormoblasto basofílico se convierte de una célula con un núcleo grande y un volumen de 900 fL a un disco enucleado con un volumen de 95 fL. En la etapa de reticulocitos, la célula ha extrudido su núcleo, pero todavía es capaz de producir hemoglobina.
Esenciales para la maduración de los glóbulos rojos son la vitamina B12 (cobalamina) y la vitamina B9 (ácido fólico). La carencia de cualquiera de las dos hace que la maduración fracase en el proceso de eritropoyesis, que se manifiesta clínicamente como reticulocitopenia, una cantidad anormalmente baja de reticulocitos.
Características observadas en los eritrocitos durante la eritropoyesis[editar]
A medida que maduran, cambian algunas características de los eritrocitos: El tamaño de la célula se reduce y la matriz citoplásmica aumenta en cantidad y la reacción de tinción del citoplasma cambia de azul a rojo rosado debido a la disminución de la cantidad de ARN y ADN . Inicialmente, el núcleo es de gran tamaño y contiene cromatina abierta. Pero a medida que los glóbulos rojos maduran el tamaño del núcleo disminuye y finalmente desaparecen con la condensación del material de la cromatina.[5]
## Regulación de la eritropoyesis[editar]
Un ciclo de retroalimentación que implica la eritropoyetina ayuda a regular el proceso de eritropoyesis de modo que, en estados que no son de enfermedad, la producción de glóbulos rojos es igual a la destrucción de glóbulos rojos y el número de glóbulos rojos es suficiente para mantener suficientes niveles de oxígeno tisular pero No tan alto como para causar lodo, trombosis o accidente cerebrovascular. La eritropoyetina se produce en el riñón y el hígado en respuesta a bajos niveles de oxígeno. Además, la eritropoyetina está unida por los glóbulos rojos circulantes; bajos números circulantes conducen a un nivel relativamente alto de eritropoyetina no unida, la cual estimula la producción en la médula ósea.
Algunos estudios recientes también han demostrado que la hormona peptídica hepcidina puede desempeñar un papel importante en la regulación de la producción de hemoglobina y, por lo tanto, influir en la eritropoyesis. El hígado produce hepcidina. La hepcidina controla la absorción de hierro en el tracto gastrointestinal y la liberación de hierro del tejido reticuloendotelial. El hierro debe ser liberado de los macrófagos en la médula ósea para ser incorporado en el grupo hemo de la hemoglobina en los eritrocitos. Hay unidades de formación de colonias que las células siguen durante su formación. Estas células se denominan células comprometidas incluyendo las unidades formadoras de colonias de monocitos de granulocitos.
La secreción de hepcidina es inhibida por otra hormona, eritroferrona, producida por eritroblastos en respuesta a eritropoyetina, e identificada en 2014.[6][7] Parece que esta vincula la eritropoyesis impulsada por la eritropoyetina con la movilización de hierro necesaria para la síntesis de la hemoglobina.
La pérdida de función del receptor de la eritropoyetina o JAK2 en las células de los ratones causa falla en la eritropoyesis, por lo que la producción de glóbulos rojos en los embriones y el crecimiento se interrumpe. Si no hubiera inhibición de retroalimentación, como supresores de proteínas de señalización de citoquinas en el sistema, eso causaría gigantismo en los ratones.[8][9]
Véase también[editar]
- Anemia: un trastorno caracterizado por contar con un nivel anormalmente bajo de hemoglobina funcional.
- Policitemia: un trastorno caracterizado por tener un nivel anormalmente alto de glóbulos rojos.
Referencias[editar]
- ↑ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc. p. 123. ISBN 978-0-07-163340-6.
- ↑ Sherwood, L, Klansman, H, Yancey, P: Animal Physiology, Brooks/Cole, Cengage Learning, 2005.
- ↑ «Developmental biology of erythropoiesis». Blood Rev. 12 (2): 106-14. June 1998. PMID 9661799. doi:10.1016/S0268-960X(98)90022-4. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Le, Tao; Bhushan, Vikas; Vasan, Neil (2010). First Aid for the USMLE Step 1: 2010 20th Anniversary Edition. USA: The McGraw-Hill Companies, Inc. p. 124. ISBN 978-0-07-163340-6.
- ↑ Textbook of Physiology by Dr. A. K. Jain reprint 2006-2007 3rd edition.
- ↑ Koury, M.J. «Erythroferrone: A Missing Link in Iron Regulation». The Hematologist. American Society of Hematology. Consultado el 26 August 2015.
- ↑ «Identification of erythroferrone as an erythroid regulator of iron metabolism». Nature Genetics 46 (7): 678-84. Jul 2014. PMC 4104984. PMID 24880340. doi:10.1038/ng.2996. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Severe iron deficiency anemia in transgenic mice expressing liver hepcidin». Proc. Natl. Acad. Sci. U.S.A. 99 (7): 4596-601. April 2002. PMC 123693. PMID 11930010. doi:10.1073/pnas.072632499. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Michael Föller; Stephan M. Huber; Florian Lang (August 2008). «Erythrocyte programmed cell death.». IUBMB Life 60 (10): 661-668. PMID 18720418. doi:10.1002/iub.106.
