Usuario:Marianabece96/Agonista nicotínico
Un agonista nicotínico es una droga que imita la acción de la acetilcolina (ACh) en los receptores de acetilcolina (nAChRs). El nAChR es nombrado por su afinidad a la nicotina. Los ejemplos incluyen la nicotina (por definición), acetilcolina (el agonista endógeno de receptores nicotínicos de acetilcolina), Colina, epibatidine,
lobeline, vareniclina y cisteína.
Historia[editar]

La nicotina es bien conocida desde hace siglos por su efecto intoxicante. La primera vez que fue aislada de la planta del tabaco, fue en 1828. Esto lo logró el químico alemán Posselt Reiman.[1]
Los efectos positivos en la memoria de los animales fueron descubiertos por investigaciones, a mediados de 1980. Esas investigaciones dieron paso a una nueva era de los estudios en el receptor nicotínico de acetilcolina (nAChR) y su estimulación, cabe mencionar que hasta ese entonces, el foco de investigación había estado centrado únicamente en la adicción a la nicotina.[2][3]
El desarrollo del agonista nAChR empezó a inicios de 1990, despues del descubrimiento de los efectos positivos de la nicotina. Algunos investigadores mostraron una posible opción de terapia en investigaciones preclíncas. ABT-418 fue uno de las primeras serie de agonistas nAChR y fue designado por Abbott Labs.[3] ABT-418 mostró un aumento significativo de retraso en el cumplimiento de igualación a la muestra (DMTS) en monos macacos madurado de diferentes especies y el sexo.[4] ABT-418 también ha sido examinada como un posible tratamiento para la enfermedad de Alzheimer, enfermedades y trastornos por déficit de atención con hiperactividad de Parkinson: oen experimentos mostraron resultados positivos.[3]
Uno de los de los primeros compuestos activos de nAChR, aparte de la nicotina, la cual fue catalogada como una droga, fue la galantamina. Es una planta alkaloide que trabaja como un inhibidor leve de colinesterasa (IC50=5µM) así como un sensibilizador para nAChRs alostéricos (CE50=50 nM).[5]
Receptores nicotínicos de acetilcolina y su sistema de señalización[editar]

Sistema de señalización[editar]
En el sistema nervioso del humano, las señales colinérgicas son extendidas a lo largo del sistema, en donde el neurotransmisor de acetilcolina (ACh) juega un papel activador de receptor ionotrópico.[6] El sistema colinérgico es vital en la via nerviosa, en donde las neuronas colinérgicas se sintetizan, se almacenan y liberan neurotransmisores ACh.
Los principales receptores que convierten los mensajes de ACh son los receptores colinérgicos muscarínicos de acetilcolina, neuronales y musculares nAChR. Mirando hacia atrás en la historia evolutiva, ACh se consideraba la molécula transmisora más antigua y se hizo presente antes de la célula nerviosa. En el sistema nervioso, la estimulación colinérgica está mediada por nAChR, la cual controla las vías tales como la liberación de transmisores y sensibilidad de las células, lo que puede influir en la actividad fisiológica incluyendo el sueño, la ansiedad, el procesamiento del dolor y de las funciones cognitivas.[7]
Receptores nicotínicos de acetilcolina[editar]
NAChRs son colinérgicos que se encuentran en el sistema nervioso central (SNC), sistema nervioso periférico (SNP) y los músculos esqueléticos, estos receptores son receptores ionotrópicos con sitios de enlace para la acetilcolina y otras moléculas. Cuando ACh u otros agonistas se unen a los receptores que estabiliza el estado abierto del canal iónico permitiendo la afluencia de cationes como el potasio, el calcio y los iones del sodio. Los nAChRs están compuestas por diferentes subunidades que determinan la estructura cuaternaria del receptor, dichas subunidades son subunidades α (α1-α10), subunidades β (β1-β4), una δ subunidades, una subunidad γ y una subunidad ε. nAChRs puede ser heteromerico o homomerico.
Los receptores heteroméricos encontrados en el sistema nervioso central, están compuesto por dos subunidades α y β tres subunidades con el enlace a la interfaz del sitio de la subunidad α y adyacentes. Estos receptores contienen dos sitios de unión al receptor y tienen diferente afinidad por sustancias químicas en base a la composición de subunidades. Ambos sitios de enlace trabajan juntos y, por lo tanto, ambos sitios necesitan estar ocupados con un agonista nAChR para que pueda tener lugar la activación del canal.[8] nAChRs contiene α2-α6 y β2-β4 subunidades han demostrado tener mayor afinidad por otros receptores de ACh. Receptores Homomericos contienen 5 subunidades idénticas, tienen 5 sitios de enlace situado en la interfaz entre dos subunidades adyacentes. En el año 2000 dos homomeric receptores habían sido identificadas en los seres humanos, el α7 y α8 receptores.[7][9][10][11]
Sitio de unión[editar]
Hay dos sitios de unión en nAChR heteroméricos; para estabilizar la forma abierta de nAChR, ambos sitios de unión deben ser ocupados por agonista, como la nicotina o la ACh.[10]
El sitio de unión de ACh nAChR se componen por seis bucles, denominado A-F. Los bucles de A, B y C del sitio de unión hijo parte de la subunidad α y son los principales componentes del sitio de unión. La subunidad adyacente a la subunidad α (γ, δ, ε o β) contiene el D, E y F bucles.[10]
Mecanismo de acción[editar]

α4β2 Receptor agonista[editar]
a4β2 nAChR contener dos subunidades a4 y tres subunidades beta 2, por lo tanto, tiene dos sitios de unión para el ACh y otros agonistas. Α4β2 nAChR representan los aproximadamente el 90% de los R-nic en el cerebro humano y cuando se exponen de forma crónica a la nicotina u otros agonistas de nicotina lleva a un aumento en la densidad de receptores α4β2, que es lo contrario de lo que suele ocurrir cuando otros receptores están expuestos crónicamente a sus agonistas. El receptor α4β2 ha sido ampliamente estudiado en lo que respecta a la enfermedad de Alzheimer, así como para la dependencia de la nicotina y en 2009 varios fármacos están en el mercado que se dirigen a la α4β2 nAChR específicamente.[12][13]
α7 Receptor agonista[editar]
Los receptores α7 son los receptores de acetilcolina neuronal homomeric compuesto de cinco subunidades α7 y tiene cinco ACh sitios de enlace. Anomalía en la expresión de los receptores α7 han sido reportados para influir en la progresión de enfermedades tales como la enfermedad de Alzheimer y la esquizofrenia. La α7 se cree que no tienen tanta afinidad por el receptor de la nicotina como heteromeric sino que han mostrado mayor afinidad para alpha bungarotoxin que es un antagonista nicotínico encontrado en el veneno de algunas serpientes. La focalización de los receptores α7 es, por lo tanto, pensó que sería útil en el tratamiento de la enfermedad de Alzheimer y la esquizofrenia.[8][14]
Agonista de tipo muscular[editar]
NAChR se encuentran en la unión neuromuscular y en los músculos esqueléticos. Dos receptores diferentes han sido encontrados, uno de los cuales ha sido principalmente encontrada en adultos contiene dos subunidades α1, β1, uno ε y δ, el otro se ha encontrado en los fetos y contiene, en lugar de la subunidad γ ε subunidad. Los nAChRs toman parte en la despolarización de la placa terminal muscular mediante el aumento de la permeabilidad de cationes que conducen a la contracción de los músculos esqueléticos.[15] Los nAChRs encontrados en el sistema músculo-esquelético tiene dos sitios de enlace ACh, uno de los cuales se encuentran en la interfaz entre α1 y δ subunidades a uno mientras que el otro se encuentra en la interfaz entre la α1 y γ o ε subunidades. Entre antagonistas nAChR diseñado específicamente para el sistema neuromuscular son los gases neurotóxicos y otros venenos diseñado para rápida matar a cualquiera de los seres humanos y otros animales o insectos.[11]
Unión[editar]
ACh se une a nAChR debido a la diferencia de carga entre la molécula y la superficie del receptor. Al enlazar a nAChR ACh encaja en un enlace en forma de bolsillo por bucles A, B y C, los cuales pertenecen a la subunidad α y la subunidad adyacente. Cuando está montado en el ACh vinculante los bucles de nAChR se someten a un movimiento que lleva a una coordinación de la molécula de ACh en el bolsillo mejorar los enlaces químicos entre la molécula y el receptor. Después del movimiento de los bucles que pertenecen a la subunidad α a veces es posible que la molécula de ACh forme un vínculo, por ejemplo, sal, puente a la subunidad adyacente mejorar los lazos entre el receptor y el ACh aún más.[16]
Diseño de la droga[editar]
Los fármacos que influyen en nAChR pueden ser agonistas, agonistas parciales o antagonistas. Los agonistas, por ejemplo, nicotina, sin embargo, puede actuar como agentes despolarizantes cuando se encuentran a nAChR para algún tiempo (segundos o minutos, dependiendo de la concentración y el subtipo nAChR), la exposición crónica al agonista también puede conducir a largo desactivación funcional duradera debido a la desensibilización rápida y persistente. Los agonistas parciales de nAChR se han estudiado ya que parecen ser de ayuda para dejar de fumar. Los agonistas parciales se cree que se unen a la nAChR y estimular la liberación de dopamina en porciones más pequeñas que los agonistas y por lo tanto compensar la ausencia de la nicotina.[17]
La falta de especificidad entre algunos de los agonistas nicotínicos es bien conocida y es un problema potencial cuando se utilicen para tratar enfermedades que requieren realizarse de un subtipo específico de nAChR. Entre estos agonistas no específicos son, por ejemplo ACh, nicotina y epibatidina que todos objetivo más de un subtipo de nAChR.[18]
Farmacóforo[editar]

El desarrollo de nAChR farmacóforo agonista comenzó en 1970 cuando se propuso que la unión de los agonistas a un receptor dependía de un átomo de nitrógeno cargado positivamente y un enlace de hidrógeno formando de átomo de oxígeno del carbonilo en la acetilcolina o un átomo de nitrógeno en (S) - nicotina. Desde entonces se ha demostrado que un centro catiónico, son átomos electronegativos y capaces de formar enlaces de hidrógeno a lo largo con el centro del anillo de piridina en nicotina (S) son favorables. Estereoquímica es una parte de la farmacóforo como se ve claramente con (S) - y (R) - nicotina, donde los enantiómero (S) se 10-100 veces más potente. El anillo de azabicıclico epibatidina es otro ejemplo de las interacciones estéricas favorables a los receptores. Se ha sugerido que una distancia internitrogen específica, N + N, es importante para la afinidad agonista pero debate ha surgido con respecto a su influencia. Una teoría más reciente es que una distancia de 7-8 Å entre los puntos que complementan el átomo de nitrógeno y mejorará la potencia.
La baja densidad electrónica cerca de las sales protonadas nitrógeno y mayor densidad de electrones cerca del anillo de piridina se ve favorecida en sales protonadas ligandos de nicotina que contiene el anillo de piridina. En años posteriores, los investigadores han tomado más interés en la α7 y α4β2 receptores subtipo en el desarrollo de un fármaco para tratar la dependencia a la nicotina y deterioro cognitivo como la enfermedad de Alzheimer.[19]
Relación estructura-actividad[editar]
Agonista muscular nAChR[editar]
Diversos modelos han sido ejecutar donde la afinidad de nAChR agonistas del receptor subtipo son probados para ayudar a identificar las moléculas, grupos estéricos y conformación que son vitales para una mayor afinidad. Mediante un subtipo de receptor nAChR musculares (α1)2β1δγ modelo se obtuvieron los siguientes resultados:
- anatoxina > epibatidinea > acetilcolina> DMPP >> cisteína > pirantel >nicotina> cicutina > tubocurarina > lobelina,
en donde la anatoxin tuvo la mayor actividad y eficacia tubocurare el más bajo. La acetilcolina inducida por otro lado mucho más tiempo de apertura del receptor aunque anatoxin es más potente. Los resultados sugieren que los derivados anatoxina sería útil para comprender relaciones estructura-actividad (SAR) para el músculo nAChRs.[20]
El cloruro de succinilcolina, que es un medicamento que ya está en el mercado, es un éster bischoline y un relajante muscular de acción corta. ésteres Bischoline son compuestos que pueden actuar como un agonista competitivo en nAChRs de tipo muscular y se han utilizado en estudios de SAR. En un Torpedo (α1) 2β1δγ modelo nAChR se demostró que la potencia de los agonistas de éster bischoline depende de la longitud de cadena como la potencia aumenta con cadenas más largas. La eficacia parece ser independiente de la longitud de la cadena desde la más alta eficacia se ve en ésteres bischoline con seis y cincuenta y seis CH2.[21]
Relaciones estructura-actividad: α4β2 agonistas nAChR[editar]

La combinación de elementos estructurales de ACh y nicotina, así como la reducción de la flexibilidad conformacional mediante el uso de un anillo de ciclopropano ha llevado al descubrimiento de ligandos de nAChR α4β2 potentes y selectivos. La modulación de tres elementos estructurales, el enlazador, la sustitución en el grupo amino y el anillo de piridina se puede utilizar para determinar la influencia en la potencia y selectividad de los ligandos. Los factores que disminuyen la unión son el impedimento estérico en el grupo amino y enlazadores que están saturados / cadenas de carbono insaturados. Se prefieren los enlazadores de éter de cadena corta. Los efectos beneficiosos sobre la unión que pueden observar con la sustitución en el anillo de piridina tanto mono y disustitución con halógenos, entre otros grupos. La sustitución en el grupo amino con tres diferentes amidas aumentó la afinidad de unión donde la metilamida tenían el más alto grade de unión. Disminuir la unión de las otras amidas sustituidas explica el por qué del impedimento estérico o la falta de un grupo metilo que resulta en la pérdida de interacción hidrofóbica. Estereoquímica de nitrógeno de la piridina y / o el anillo de piridina y sus efectos estereoelectrónicos tiene un efecto beneficioso sutil en la unión a la α4β2 nAChR. De este modo se demostró que un ligando de éter de piridilo, con la sustitución bromo en la piridina y metylatedamide en el grupo amino tenía la más alta potencia.[22]
Relaciones estructura-actividad: agonistas de los receptores α7 nAChR[editar]


La búsqueda de a7 selectivo y potente agonistas de nAChR ha producido una serie de compuestos que tienen un buen potencial como candidatos a convertirse en fármacos. Un registro de este tipo producido SEN12333 / WAY-317538 entre otros compuestos que tienen perfiles farmacocinéticos deseables y son selectivos de nAChR a7 más de α1, α3 y nAChR α4β2. Se han propuesto las relaciones estructura actividad para estos compuestos.[14]
El farmacóforo óptimo del agonista α7 nAChR está hecho de tres partes. Hay un resto básico conectado a una cadena de carbono unido a un resto aromático por un puente de amida. El puente de amida se puede invertir sin afectar la potencia del agonista. Un grupo biarilo muestra más potencia que un grupo de monoarilo como el resto aromático y sustitución en la posición 2 en el grupo arilo más tarde aumentará aún más la potencia. La potencia es mayor para los agonistas con H + donador / aceptor en el grupo arilo más adelante en el grupo biarilo. Un alto número de aceptores de enlace de hidrógeno podría disminuir la permeabilidad a través de la barrera hematoencefálica (BBB), debido a la superficie polar y necesita ser tenido en cuenta en el diseño de agonistas para apuntar nAChR a7.[14]
Varios grupos amino cíclicos pueden actuar como el resto básico y la potencia se mantiene relativamente sin cambios, por ejemplo, arilo piperazina, piperidina y morfolina. Una amina terciaria acíclica se tolera como el resto básico pero los grupos estéricos de ellos es menos tolerada.[14]
Muchos derivados de quinuclidina tales como amida de quinuclidina, son conocidos por ser agonistas de nAChR a7. Los estudios de SAR para amida quinuclidina han identificado los factores que afectan a la potencia y la afinidad de estos agonistas. Para la sustitución en el anillo de quinuclidina y la configuración de 3- (R) en la estereoquímica es favorecida. Se observa una mayor actividad cuando un anillo de 5 miembros que se fusiona al resto aromático. Además, la mejora se ve cuando el anillo fusionado es capaz de suministrar de resonancia de electrones al carbonilo de la amida mientras que la actividad disminuirá cuando el anillo condensado contiene un enlace de hidrógeno donar átomo. La rigidez de quinuclidina y la orientación ortogonal del puente de nitrógeno en relaciones con el grupo carbonilo de la amida se presume importante para la unión óptima. La estabilidad de algunos de los derivados de quinuclidina de amida más potentes en la rata en modelos in vitro han sido bajos sin embargo mediante la adición de un grupo metilo en la posición 2 en el anillo de quinuclidina de la estabilidad ha aumentado considerablemente.[23]
Desarrollo de drogas[editar]
El desarrollo de agonistas de receptores nicotínicos de acetilcolina comenzó a principios de la década de 1990 tras el descubrimiento de los efectos positivos de la nicotina en la memoria animal.[2][3] El desarrollo de agonistas de receptores nicotínicos de acetilcolina ha recorrido un largo camino desde entonces. Agonista del receptor nicotínico de acetilcolina están ganando una creciente atención como candidatos a fármaco para varios trastornos del sistema nervioso central, tales como la enfermedad de Alzheimer, la esquizofrenia, el trastorno por déficit de atención con hiperactividad (TDAH) y la adicción a la nicotina.[24][25] Los receptores nicotínicos de acetilcolina son receptores que se encuentran en el sistema nervioso central, el sistema nervioso periférico y los músculos esqueléticos. Están ligados con los receptores ionotrópicos con sitios de enlace para la acetilcolina así como otros agonistas. Cuando los agonistas de ligarse a un receptor que estabiliza el estado abierto del canal iónico permitiendo la afluencia de cationes.[8]
En 2009 hubo al menos cinco medicamentos en el mercado que afectan a los receptores nicotínicos de acetilcolina.
Productos de agonista nicotínico[editar]
| Ingrediente Activo | Producto | Nombre químico | Farmaco | Propiedades farmacodinámicas | Uso terapeutico | Estructura |
|---|---|---|---|---|---|---|
| Vareniclina | Champix, Chantix | 7,8,9,10-tetrahydro-6,10-methano-6H-pyrazino[2,3-h][3]benzazepine[26] | Comprimidos recubiertos | Agonista parcial de los receptores nicotínicos de acetilcolina, el subtipo α4β2[27] | Tratamiento de dependencia del tabaco.[27] | 
|
| Galantamina | Reminyl, Nivalin, Razadyne and Razadyn ER | 4a,5,9,10,11,12-hexahydro-3-methoxy-11-methyl-6H-benzofuro[3a,3,2-ef][2]-benzazepin-6-ol[28] | Cápsula de liberación sostenida, film comprimido recubierto, solución oral. | Inhibidor de la colinesterasa no competitivas y un agonista del receptor nicotínico de acetilcolina[3] | Tratamiento de demencia causado por enfermedad de Alzheimer [29] | 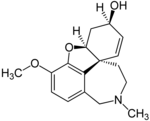
|
| Nicotina | Nicorette, Nicotinell, Niquitin, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3-[(2S)-1-methylpyrrolidine-2-yl]pyridine | Parche transdérmico, goma de mascar, inhaladores, aerosol nasal, pastillas, microtab | Agonista del receptor nicotínico,[30] tanto de tipo ganglionares y α4β2.[31] | Tratamiento de dependencia del tabaco[32] | 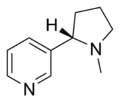
|
| Carbacol | Miostat | 2-[(aminocarbonyl)oxy]-N,N,N-trimethylethanaminium | Solución intraocular | Agonista colinérgico.[33] | Tratamiento de glaucoma | 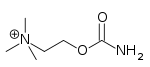
|
| Succinilcolina | Anectine, Quelicin Suxamethonium Chloride | 2,2'-[(1,4-dioxobutane-1,4-diyl)bis(oxy)]bis(N,N,N-trimethylethanaminium) | Inyección intravenosa o intramuscular | Agente bloqueante neuromuscular Depolarizing[34] | Breve acción relajante muscular[35] | |
| Epibatidina | No enlistado | 2-(6-chloropyridin-3-yl)-7-azabicyclo[2.2.1]heptane | No enlistado | Agonista del receptor nicotínico de acetilcolina[36] | No se utiliza como droga. | 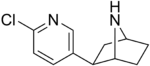
|
Otros agonistas nicotínicos, aunque por lo general con el uso clínico limitado, incluyen:
- Lobeline, un agonista de los receptores nicotínicos de tipo ganglionares y afecta también a las terminales nerviosas sensoriales.[31]
- epibatidine y agonista de tipo ganglionares α4β2 y α7 receptores.[31]
- decamethonium provoca despolarización bloque sobre los receptores de tipo muscular, al igual que el suxametonio.[31]
Estado actual[editar]
Actualmente la investigación nicotina agonista del receptor y el diseño de drogas se dirige para el tratamiento de múltiples enfermedades y trastornos del SNC.
Targacept tiene cuatro candidatos a fármacos que se encuentran en ensayos clínicos; AZD3480 (TC-1734) para el TDAH que actualmente se encuentra en II de ensayos clínicos de fase y AZD1446 (TC-6683) para la enfermedad de Alzheimer en colaboración con AstraZeneca, TC-5619 para las disfunciones cognitivas en la esquizofrenia y TC-5214 como un tratamiento de aumento de depresivo mayor trastorno (MDD) en sujetos que no responden adecuadamente al tratamiento de primera línea con bromhidrato de citalopram.[37]
Los productos farmacéuticos de memoria con su socio Roche tiene un candidato a fármaco, MEM 3454 (RG3487), un agonista parcial del
receptor nicotínico α7, para la enfermedad de Alzheimer.[38][39]
Abbott Laboratories en asociación con NeuroSearch tienen dos candidatos a fármacos en ensayos clínicos, ABT-894, un proceso selectivo α4β2 agonistas del receptor de la nicotina, para ADHD y ABT-560, un modulador del receptor nicotínico neuronal, que fue seleccionada por Abbott en 2006 como un nuevo candidato para el desarrollo de disfunciones cognitivas.[40]
EnVivo pharmaceuticals tiene uno de los fármacos candidatos en ensayos clínicos, EVP-6124, un proceso selectivo α7 agonista del receptor de la nicotina para la enfermedad de Alzheimer y la esquizofrenia y una de seguimiento compuesto, EVP-4473, que ha completado exitosamente un desarrollo pre-clínico.[41]
Referencias[editar]
- ↑ Henningfield, Jack E; Zeller, Mitch (2006), «Nicotine psychopharmacology research contributions to United States and global tobacco regulation: a look back and a look forward», Psychopharmacology 184 (3–4): 286-291, PMID 16463054, doi:10.1007/s00213-006-0308-4.
- ↑ a b Haroutunian, Vahram; Barnes, Edward; Davis, KL (1985), «Cholinergie modulation of memory in rats», Psychopharmacology 87 (3): 266-271, PMID 3001803, doi:10.1007/BF00432705.
- ↑ a b c d e Buccafusco, J. J. (2004), «Neuronal nicotinic receptor subtypes: defining therapeutic targets», Molecular intervention 4 (5): 285-295, doi:10.1124/mi.4.5.8.
- ↑ Buccafusco, J. J.; Jackson, W. J.; Terry Jr, AV; Marsh, KC; Decker, MW; Arneric, SP (1995), «Improvement in performance of a delayed matching-to-sample task by monkeys following ABT-418: a novel cholinergic channel activator for memory enhancement», Psychopharmacology 120 (3): 256-266, PMID 8524972, doi:10.1007/BF02311172.
- ↑ Ludwig, J.; Höffle-Maas, A. (2010), «Localization by site-directed mutagenesis of a galantamine binding site on α7 nicotinic acetylcholine receptor extracellular domain», Journal of Receptor and Signal Transduction 30 (6): 469-483, doi:10.3109/10799893.2010.505239.
- ↑ Liu, Zhaoping; Zhang, J; Berg, Darwin K. (2007), «Role of endogenous nicotinic signaling in guiding neuronal development», Biochemical pharmacology 74 (8): 1112-1119, PMC 2116993, PMID 17603025, doi:10.1016/j.bcp.2007.05.022.
- ↑ a b Gotti, C.; Clementi, F. (2004), «Neuronal nicotinic receptors: from structure to pathology», Progress in Neurobiology 74 (6): 363-396, PMID 15649582, doi:10.1016/j.pneurobio.2004.09.006.
- ↑ a b c Paterson, David; Nordberg, Agneta (2000), «Neuronal nicotinic receptors in the human brain», Progress in neurobiology 61 (1): 75-111, PMID 10759066, doi:10.1016/s0301-0082(99)00045-3.
- ↑ Sala, F.; Nistri, A.; Criado, M. (2008), «Nicotinic acetylcholine receptors of adrenal chromaffin cells», Acta Physiologica 192 (2): 203-212, PMID 18005395, doi:10.1111/j.1748-1716.2007.01804.x.
- ↑ a b c Itier, Valérie; Bertrand, Daniel (2001), «Neuronal nicotinic receptors: from protein structure to function», FEBS Letters 504 (3): 118-125, PMID 11532443, doi:10.1016/S0014-5793(01)02702-8.
- ↑ a b Lindstrom, JM (2003), «Nicotinic acetylcholine receptors of muscles and nerves», Annals of the New York Academy of Sciences 998: 41-52, doi:10.1196/annals.1254.007.
- ↑ Mihailescu, Stefan; Drucker-Colín, René (2000), «Nicotine, Brain Nicotinic Receptors, and Neuropsychiatric Disorders», Archives of Medical Research 31 (2): 131-144, PMID 10880717, doi:10.1016/S0188-4409(99)00087-9.
- ↑ Arias, Hugo R. (1997), «Topology of ligand binding sites on the nicotinic acetylcholine receptor», Brain Research Reviews 25 (2): 133-191, PMID 9403137, doi:10.1016/S0165-0173(97)00020-9.
- ↑ a b c d Haydar, Simon N.; Ghiron, Chiara; Bettinetti, Laura; Bothman, Hendrick; Comery, Thomas A.; Dunlop, John; La Rosa, Salvatore; Micco, Iolanda; Pollastrini, Martina; Quinn, Joanna; Roncarati, Renza; Scali, Carla; Valacchi, Michela; Varrone, Maurizio; Zanaletti, Riccardo (2009), «SAR and biological evaluation of SEN12333/WAY-317538: Novel alpha 7 nicotinic acetylcholine receptor agonist», Bioorganic & Medicinal Chemistry 17 (14): 5247-5258, PMID 19515567, doi:10.1016/j.bmc.2009.05.040.
- ↑ Brunton, Laurence L.; Lazo, John S.; Parker, Keith L., eds. (2006), Goodman & Gilman‘s The Pharmacological Basis of Therapeutics (11 edición), McGRAW HILL, ISBN 0-07-142280-3.
- ↑ Unwin, Nigel (2004), «Refined Structure of the Nicotinic Acetylcholine Receptor at 4 A° Resolution», Journal of Molecular Biology 346 (4): 967-989, PMID 15701510, doi:10.1016/j.jmb.2004.12.031.
- ↑ Cassels, Bruce K.; Bermúdez, Isabel; Dajas, Federico; Abin-Carriquiry, J. Andrés; Wonnacott, Susan (2005), «From ligand design to therapeutic efficacy: the challenge for nicotinic receptor research», Drug Discovery Today 10 (23–24): 1657-1665, PMID 16376826, doi:10.1016/S1359-6446(05)03665-2.
- ↑ Gotti, C.; Fornasari, D.; Clementi, F. (1997), «Human Neuronal Nicotinc Receptors», ProgressinNeurobiology 53 (2): 199-237, doi:10.1016/S0301-0082(97)00034-8.
- ↑ Tøndera, Janne E.; Olesena, Preben H.; Hansena, John Bondo; Begtrupb, Mikael; Petterssona, Ingrid (2001), «An improved nicotinic pharmacophore and a stereoselective CoMFA-model for nicotinic agonists acting at the central nicotinic acetylcholine receptors labelled by [3H]-N-methylcarbamylcholine», Journal of Computer-Aided Molecular Design 15 (3): 247-258, PMID 11289078, doi:10.1023/A:1008140021426.
- ↑ Cooper, Julia C.; Gutbrod, Oliver; Witzemann, Veit; Methfessel, Christoph (1996), «Pharmacology of the nicotinic acetylcholine receptor from fetal rat muscle expressed in Xenopus oocytes», European Journal of Pharmacology 309 (3): 287-298, PMID 8874153, doi:10.1016/0014-2999(96)00294-4.
- ↑ Carter, Chris R.J.; Cao, Liren; Kawai, Hideki; Smith, Peter A.; Dryden, William F.; Raftery, Michael A.; Dunn, Susan M.J. (2007), «Chain length dependence of the interactions of bisquaternary ligands with the Torpedo nicotinic acetylcholine receptor», Biochemical Pharmacology 73 (3): 417-426, PMID 17118342, doi:10.1016/j.bcp.2006.10.011.
- ↑ Charton, Yves; Guillonneau, Claude.; Lockhart, Brian; Lestageb, Pierre; Goldsteina, Solo (2008), «Preparation and affinity profile of novel nicotinic ligands», Bioorganic & Medicinal Chemistry Letters 18: 2188-2193, doi:10.1016/j.bmcl.2007.12.075.
- ↑ Walker, Daniel P.; Wishka, Donn G.; Piotrowski, David W.; Jia, Shaojuan; Reitz, Steven C.; Yates, Karen M.; Myers, Jason K.; Vetman, Tatiana N.; Margolis, Brandon J.; Jacobsen, E. Jon; Acker, Brad A.; Groppi, Vincent E.; Wolfe, Mark L.; Thornburgh, Bruce A.; Tinholt, Paula M.; Cortes-Burgos, Luz A.; Walters, Rodney R.; Hester, Matthew R.; Seest, Eric P.; Dolak, Lester A.; Han, Fusen; Olson, Barbara A.; Fitzgerald, Laura; Staton, Brian A.; Raub, Thomas J.; Hajos, Mihaly; Hoffmann, William E.; Li, Kai S.; Higdon, Nicole R. et al. (2006), «Design, synthesis, structure–activity relationship, and in vivo activity of azabicyclic aryl amides as a7 nicotinic acetylcholine receptor agonists», Bioorganic & Medicinal Chemistry 14 (24): 8219-8248, PMID 17011782, doi:10.1016/j.bmc.2006.09.019.
- ↑ http://www.envivopharma.com - Nicotinic Alpha7 Acetylcholine Receptor Agonist Program
- ↑ Rollema, H.; Chambers, L.K; Coe, J.W.; Glowa, J.; Hurst, R.S.; Lebel, L.A; Lu, Y.; Mansbach, R.S.; Mather, R.J.; Rovetti, C.C.; Sands, S.B.; Schaeffer, E.; Schulz, D.W.; Tangley III, F.D.; Williams, K.E. (2007), «Pharmacological profile of the α4β2 nicotinic acetylcholine receptor partial agonist varenicline, an effective smoking cessation aid», Neuropharmacology 52: 985-994, PMID 17157884, doi:10.1016/j.neuropharm.2006.10.016.
- ↑ Rollema, H.; Chambers, L.K; Coe, J.W.; Glowa, J.; Hurst, R.S.; Lebel, L.A; Lu, Y.; Mansbach, R.S.; Mather, R.J.; Rovetti, C.C.; Sands, S.B.; Schaeffer, E.; Schulz, D.W.; Tangley III, F.D.; Williams, K.E. (2007), «Pharmacological profile of the α4β2 nicotinic acetylcholine receptor partial agonist varenicline, an effective smoking cessation aid», Neuropharmacology 52: 985-994, PMID 17157884, doi:10.1016/j.neuropharm.2006.10.016.
- ↑ a b http://emc.medicines.org.uk
- ↑ Greenblatt, H.M.; Kryger, G.; Lewis, T.; Silman, I.; Sussman, J.L (1999), «Structure of acetylcholinesterase complexed with (-)-galanthamine at 2.3 angstrom resolution», FEBS Letters 463: 321-326, PMID 10606746, doi:10.1016/S0014-5793(99)01637-3.
- ↑ http://emc.mediciness.org/galantamine
- ↑ Dani, John A.; Biasi, Mariella De (2001), «Cellular mechanisms of nicotine addiction», Pharmacology, Biochemistry and Behavior 70: 439-446, doi:10.1016/S0091-3057(01)00652-9.
- ↑ a b c d Rang, H. P. (2003), Pharmacology, Edinburgh: Churchill Livingstone, ISBN 0-443-07145-4. Page 149
- ↑ XI, Zheng-xiong; Spiller, Krista; Gardner, Eliot L. (2009), «Mechanism-based medication development for the treatment of nicotine dependence», Acta Pharmacol Sin 30 (6): 723-739, doi:10.1038/aps.2009.46.
- ↑ http://www.accessdata.fda.gov
- ↑ Tuba, Zoltan; Maho, Sandor; Vizi, E. Sylvester (2002), «Synthesis and Structure-Activity Relationships of Neuromuscular Blocking Agents», Current Medicinal Chemistry 9: 1507-1536, doi:10.2174/0929867023369466.
- ↑ http://emc.medicines.org.uk/suxamethonium
- ↑ Carroll, F. Ivy (2004), «Epibatidine structure-activity relationships», Bioorganic & Medicinal Chemistry Letters 14 (8): 1889-1896, PMID 15050621, doi:10.1016/j.bmcl.2004.02.007.
- ↑ http://www.targacept.com
- ↑ http://www.roche.com
- ↑ http://www.medicalnewstoday.com
- ↑ http://www.neurosearch.dk
- ↑ http://www.envivopharma.com
Links Externos[editar]
- MeSH: nicotinic+agonists (en inglés)
