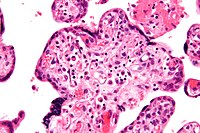
Vilitis de etiología desconocida
| Vilitis de etiología desconocida | ||
|---|---|---|
 Micrografía de vilitis de etiología desconocida. Tinción H&E. | ||
| Especialidad | Patología, ginecología | |
| Sinónimos | ||
| Villitis crónica | ||
La vilitis de etiología desconocida (VUE, del inglés Villitis of unknown etiology), también conocida como vilitis crónica, es una lesión placentaria. Es una condición inflamatoria que involucra las vellosidades coriónicas (vellosidades placentarias). Además, es una condición recurrente y puede estar asociada con la restricción del crecimiento intrauterino (RCIU). La RCIU implica el crecimiento deficiente del feto, la muerte fetal, el aborto espontáneo y el parto prematuro.[1][2] Se repite en aproximadamente 1/3 de los embarazos posteriores.[3]
Es una lesión común caracterizada por inflamación en las vellosidades coriónicas placentarias. VUE también se caracteriza por la transferencia de linfocitos maternos a través de la placenta.[2]
Se diagnostica en 7 a 10% de placentas en embarazos. Aproximadamente el 80% de los casos de VUE son placentas a término (más de 37 semanas de embarazo). Un caso de VUE en una placenta de menos de 32 semanas debe ser examinado para detectar villitis infecciosa.[1]
Patogénesis[editar]
Las células inflamatorias de origen materno podrían acceder al estoma velloso fetal de múltiples formas:
La barrera del trofoblasto velloso podría dañarse. En el tercer trimestre, los nudos sincitiales se desprenden de las vellosidades placentarias fetales. El desprendimiento puede desnudar el estroma velloso. La barrera podría romperse por trombosis fetal anterior o daño isquémico por infarto materno. La necrosis de los sincitiotrofoblastos podría surgir como resultado de la activación de los componentes de la coagulación, el sistema del complemento o las plaquetas por parte de anticuerpos o antifosfolípidos.[4]
Se puede hacer que los sincitiotrofoblastos exhiban moléculas de adhesión (molécula de adhesión intracelular 1, E-selectina) en VUE, aunque en condiciones normales no se expresan moléculas de adhesión.[5]
Los linfocitos maternos pueden entrar en el estroma fetal atravesando la barrera trofoblástica de las vellosidades a través de las vellosidades de anclaje. Las vellosidades de anclaje pierden su capa de sincitiotrofoblasto epitelial continuo a medida que las vellosidades maduran y se convierten en trofoblastos intermedios invasivos a lo largo del curso de desarrollo de la placenta. Las células estromales deciduales expresan un factor trófico, IL-15, para las células T de memoria CD8+. El tráfico de linfocitos maternos respondiendo a un antígeno en la deciduitis crónica podría activarse y entrar por la decidua.[6][7]
La VUE es una reacción inflamatoria mediada por células T con predominio de CD8+. La VUE se desarrolla en el estroma de fibrovasculatura fetal de las vellosidades de la placenta, generalmente hacia el final del embarazo (placentas a término).[1] Los linfocitos en VUE son de origen materno. VUE es una respuesta inflamatoria derivada del huésped que ocurre dentro de un tejido de aloinjerto de donante. El componente que no es de células T del infiltrado inflamatorio se origina tanto en el lado materno como en el placentario. La mayoría de las células presentadoras de antígenos eran células de Hofbauer (macrófagos) de origen fetal.[8][9] Los monocitos-macrófagos perivellosos y las células gigantes histiocíticas eran de origen materno.[10] Los macrófagos fetales en VUE proliferan y se activan como resultado de la regulación positiva de la expresión del antígeno MHC de clase 2.[11][12][13] El examen de una placenta masculina con VUE demostró que el 11,2 % de los linfocitos CD3+ intravellosos eran fetales y el 88,8 % eran maternos. Los macrófagos, los linfocitos intervellosos, las células gigantes multinucleadas eran maternos; El 10,5% de las células intravellosas CD68+ y el 96,4% de las perivellosas CD68+ eran maternas. Los linfocitos eran predominantemente células T maternas.[10] Las células maternas pueden entrar en las vellosidades placentarias y también en el feto.[14]
Diagnóstico[editar]
La VUE puede ser de 2 tipos, villitis crónica de bajo grado o villitis crónica de alto grado. La vellosidad crónica de bajo grado involucra menos de 10 vellosidades que contienen linfocitos. La vilitis crónica de bajo grado puede ser focal o multifocal. Focal ha involucrado vellosidades en solo un portaobjetos de vidrio, mientras que multifocal ha involucrado vellosidades en al menos dos portaobjetos. La vellosidad crónica de alto grado tiene más de 10 vellosidades inflamadas por foco. La villitis crónica de alto grado se diferencia en difusa y parcheada. El término parcheado se usa si menos del 30% de las vellosidades distales están involucradas. El término difusa se utiliza si más del 30% de las vellosidades distales están involucradas.
La VUE tiene 2 patrones distintos prominentes. Aproximadamente el 50% de los casos únicamente involucran las vellosidades distales (vellosidades intermedias y terminales maduras) y no involucran las vellosidades del tallo proximal, las vellosidades de anclaje incrustadas en la placa basal y la placa coriónica. El segundo patrón más común (aproximadamente el 30% de los casos de VUE) involucra las vellosidades del tallo proximal (y posiblemente la placa coriónica) y, por lo general, las vellosidades distales. Este tipo de VUE está relacionado con lesiones obstructivas vasculares fetales (vasculopatía fetal obliterante).[1][15]
La VUE no tiene signos y síntomas clínicos específicos que sugieran el diagnóstico; pero un análisis del filtrado inflamatorio puede ayudar en el diagnóstico.[1] La composición del infiltrado inflamatorio en VUE a nivel celular es principalmente macrófagos y linfocitos. Las proporciones relativas de las células varían caso por caso. Los linfocitos presentes en VUE son predominantemente células T CD8+ y luego CD4. Suele haber una proporción de 0,1 a 0,5 para CD4/CD8.[16][17] Los macrófagos presentes son principalmente Mac387-, seguido de CD68 y HAM56+. Los antígenos del complejo principal de histocompatibilidad (MHC) de clase 2 en los macrófagos están regulados al alza en los sitios de VUE. Los neutrófilos no deben estar presentes en los sitios de VUE. VUE es una condición que involucra inflamación y no inflamación. Un alto número de neutrófilos está presente en la vilitis infecciosa y no en la VUE.[1][13]
Histopatología[editar]
Histomorfológicamente, la VUE se caracteriza por un infiltrado linfocitario de las vellosidades coriónicas sin una causa demostrable. Las células plasmáticas deben estar ausentes; la presencia de células plasmáticas sugiere una etiología infecciosa, por ejemplo, infección por CMV.
-
Villitis crónica de bajo grado
-
Villitis crónica de alto grado
Diagnóstico diferencial[editar]
La VUE a menudo se confunde con vilitis infecciosa. Se pueden diferenciar por las siguientes características: No hay signos de infección ni en la madre ni en el lactante con VUE. Vellosidades infecciosas hay infección tanto materna como fetal. VUE es más común que la vilitis infecciosa; La villitis infecciosa está presente en aproximadamente 1 a 4 nacimientos por cada 1000 nacimientos. VUE está presente en aproximadamente 76 a 136 nacimientos por cada 1000 nacimientos. La VUE ocurre en la placenta a término, a fines del tercer trimestre del embarazo. La villitis infecciosa ocurre entre principios del tercer y finales del segundo trimestre del embarazo. Las vellosidades infecciosas involucran una mayor parte de la placenta (cordón umbilical, placa coriónica, membranas ) en comparación con VUE (vellosidades terminales y de tallo). Histológicamente, la VUE se caracteriza por la presencia de más linfocitos que la vilitis infecciosa. La recurrencia de la vilitis infecciosa es rara. VUE tiene una tasa de recurrencia del 10% al 15%.[1]
Prevención[editar]
No se conocen métodos de prevención para VUE, pero se prevé que podría deberse a una infección por Treponema pallidum, Toxoplasma gondi y citomegalovirus.[1]
Epidemiología[editar]
En Nueva Zelanda, VUE es más común en los caucásicos que en los maoríes y de ascendencia asiática. Las mujeres obesas tienen más probabilidades de desarrollar VUE; esto podría deberse a que las mujeres obesas tienen placentas más grandes, por lo que tienen una mayor cantidad de macrófagos vellosos, lo que podría aumentar la eficiencia de la presentación de antígenos que resulta en VUE.[18]
Véase también[editar]
Referencias[editar]
- ↑ a b c d e f g h Redline, Raymond W. (2007-10). «Villitis of unknown etiology: noninfectious chronic villitis in the placenta». Human Pathology 38 (10): 1439-1446. ISSN 0046-8177. PMID 17889674. doi:10.1016/j.humpath.2007.05.025.
- ↑ a b Tamblyn, J. A.; Lissauer, D. M.; Powell, R.; Cox, P.; Kilby, M. D. (2013-10). «The immunological basis of villitis of unknown etiology - review». Placenta 34 (10): 846-855. ISSN 1532-3102. PMID 23891153. doi:10.1016/j.placenta.2013.07.002.
- ↑ Feeley, L.; Mooney, E. E. (2010). «Villitis of unknown aetiology: correlation of recurrence with clinical outcome». Journal of Obstetrics and Gynaecology: The Journal of the Institute of Obstetrics and Gynaecology 30 (5): 476-479. ISSN 1364-6893. PMID 20604650. doi:10.3109/01443611003802339.
- ↑ Nelson, D. M.; Crouch, E. C.; Curran, E. M.; Farmer, D. R. (1990-04). «Trophoblast interaction with fibrin matrix. Epithelialization of perivillous fibrin deposits as a mechanism for villous repair in the human placenta». The American Journal of Pathology 136 (4): 855-865. ISSN 0002-9440. PMC 1877640. PMID 2327472.
- ↑ Labarrere, Carlos A.; Ortiz, Miguel A.; Sosa, Marcelo J.; Campana, Gonzalo L.; Wernicke, Mario; Baldridge, Lee Ann; Terry, Colin; DiCarlo, Hector L. (2005-08). «Syncytiotrophoblast intercellular adhesion molecule-1 expression in placental villitis of unknown cause». American Journal of Obstetrics and Gynecology 193 (2): 483-488. ISSN 0002-9378. PMID 16098874. doi:10.1016/j.ajog.2004.12.090.
- ↑ Ashkar, Ali A.; Black, Gordon P.; Wei, Qingxia; He, Hong; Liang, Luchuan; Head, Judith R.; Croy, B. Anne (15 de septiembre de 2003). «Assessment of requirements for IL-15 and IFN regulatory factors in uterine NK cell differentiation and function during pregnancy». Journal of Immunology (Baltimore, Md.: 1950) 171 (6): 2937-2944. ISSN 0022-1767. PMID 12960317. doi:10.4049/jimmunol.171.6.2937.
- ↑ Liu, Kebin; Catalfamo, Marta; Li, Yu; Henkart, Pierre A.; Weng, Nan-ping (30 de abril de 2002). «IL-15 mimics T cell receptor crosslinking in the induction of cellular proliferation, gene expression, and cytotoxicity in CD8+ memory T cells». Proceedings of the National Academy of Sciences of the United States of America 99 (9): 6192-6197. ISSN 0027-8424. PMID 11972069. doi:10.1073/pnas.092675799.
- ↑ Labarrere, C. A.; Faulk, W. P. (1995-01). «Maternal cells in chorionic villi from placentae of normal and abnormal human pregnancies». American Journal of Reproductive Immunology (New York, N.Y.: 1989) 33 (1): 54-59. ISSN 1046-7408. PMID 7619234. doi:10.1111/j.1600-0897.1995.tb01138.x.
- ↑ Redline, R. W.; Patterson, P. (1993-08). «Villitis of unknown etiology is associated with major infiltration of fetal tissue by maternal inflammatory cells». The American Journal of Pathology 143 (2): 473-479. ISSN 0002-9440. PMC 1887041. PMID 8342596.
- ↑ a b Myerson, David; Parkin, Rachael K.; Benirschke, Kurt; Tschetter, Clifford N.; Hyde, Scott R. (2006-07). «The pathogenesis of villitis of unknown etiology: analysis with a new conjoint immunohistochemistry-in situ hybridization procedure to identify specific maternal and fetal cells». Pediatric and Developmental Pathology: The Official Journal of the Society for Pediatric Pathology and the Paediatric Pathology Society 9 (4): 257-265. ISSN 1093-5266. PMID 16944988. doi:10.2350/08-05-0103.1.
- ↑ Altemani, A. M. (1992-04). «Immunohistochemical study of the inflammatory infiltrate in villitis of unknown etiology. A qualitative and quantitative analysis». Pathology, Research and Practice 188 (3): 303-309. ISSN 0344-0338. PMID 1625994. doi:10.1016/S0344-0338(11)81208-2.
- ↑ Kim, Mi Ran; Nien, Jyh Kae; Kim, Chong Jai; Kim, Yeon Mee; Kim, Gi Jin; Goncalves, Luis; Oh, Seo Young; Chaiworapongsa, Tinnakorn et al. (1 de diciembre de 2004). «Villitis of unknown etiology as a placental counterpart of transplantation rejection: The demonstration of cd8+ T lymphocyte and NK cell infiltration in this lesion». American Journal of Obstetrics & Gynecology (en inglés) 191 (6): S87. ISSN 0002-9378. doi:10.1016/j.ajog.2004.10.194.
- ↑ a b Labarrere, C. A.; Faulk, W. P. (1990-11). «MHC class II reactivity of human villous trophoblast in chronic inflammation of unestablished etiology». Transplantation 50 (5): 812-816. ISSN 0041-1337. PMID 2238057. doi:10.1097/00007890-199011000-00014.
- ↑ Nelson, J. Lee (2002-03). «Microchimerism: incidental byproduct of pregnancy or active participant in human health?». Trends in Molecular Medicine 8 (3): 109-113. ISSN 1471-4914. PMID 11879770. doi:10.1016/s1471-4914(01)02269-9.
- ↑ Redline, Raymond W.; Ariel, Ilana; Baergen, Rebecca N.; Desa, Derek J.; Kraus, Frederick T.; Roberts, Drucilla J.; Sander, C. Maureen (2004-09). «Fetal vascular obstructive lesions: nosology and reproducibility of placental reaction patterns». Pediatric and Developmental Pathology: The Official Journal of the Society for Pediatric Pathology and the Paediatric Pathology Society 7 (5): 443-452. ISSN 1093-5266. PMID 15547768. doi:10.1007/s10024-004-2020-x.
- ↑ Brito, H.; Juliano, P.; Altemani, C.; Altemani, A. (2005-11). «Is the immunohistochemical study of the inflammatory infiltrate helpful in distinguishing villitis of unknown etiology from non-specific infection villitis?». Placenta 26 (10): 839-841. ISSN 0143-4004. PMID 16169075. doi:10.1016/j.placenta.2004.10.012.
- ↑ Kapur, Payal; Rakheja, Dinesh; Gomez, Ana M.; Sheffield, Jeanne; Sanchez, Pablo; Rogers, Beverly Barton (2004-09). «Characterization of inflammation in syphilitic villitis and in villitis of unknown etiology». Pediatric and Developmental Pathology: The Official Journal of the Society for Pediatric Pathology and the Paediatric Pathology Society 7 (5): 453-458; discussion 421. ISSN 1093-5266. PMID 15547769. doi:10.1007/s10024-004-2124-3.
- ↑ Becroft, David M.; Thompson, John M.; Mitchell, Edwin A. (2005-01). «Placental villitis of unknown origin: epidemiologic associations». American Journal of Obstetrics and Gynecology 192 (1): 264-271. ISSN 0002-9378. PMID 15672035. doi:10.1016/j.ajog.2004.06.062.